Jiachang Biological - biotechnology services and research and development as one of the high-tech enterprises
High qualityefficienttransparent
High quality, efficient and transparent
发布时间:2022-11-23 15:49 信息来源: 阅读次数: 次
自1992年,美国生物学家Arnold Caplan教授命名 “间充质干细胞”并开启了世界上第一例间充质干细胞的临床探索至今,人类探索干细胞临床应用的历史已三十余年。干细胞是一类具有不同分化潜能,并能在非分化状态下自我更新的细胞。常用于细胞治疗的干细胞一般可分为胚胎干细胞、成体干细胞(如脂肪间充质干细胞、骨髓间充质干细胞、脐带间充质干细胞等)、诱导多能干细胞。
干细胞治疗是指应用人自体或异体来源的干细胞,经体外操作后输入(或植入)人体,用于疾病治疗。这种体外操作包括干细胞的分离、纯化、扩增、修饰、干细胞(系)的建立、诱导分化、冻存和冻存后的复苏等过程。
研究近况
目前在clinicaltrials.gov网站上已登记的干细胞临床研究项目超过1W个,10多款产品在各国已获批上市,大部分已获批上市的产品主要是根据其免疫调控和组织修复两个生物学特性应用于相应适应症,如移植物抗宿主病、膝骨关节炎、克罗恩病,严重肢体缺血等。
干细胞产品工艺简介
干细胞制剂的制备工艺包括干细胞的采集、分离、纯化、扩增和传代,干细胞(系)的建立、向功能性细胞定向分化,培养基、辅料和包材的选择标准及使用,细胞冻存、复苏、分装和标记,以及残余物去除等。
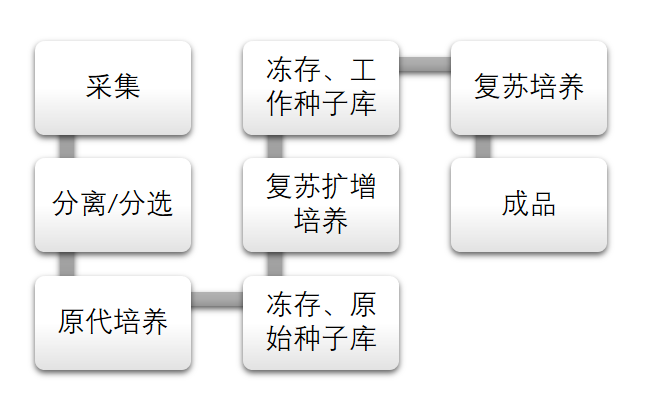
干细胞产品工艺流程▲
点击看大图
“类双轨制”监管模式
在我国,干细胞治疗产品目前处在“类双轨制”的监管阶段。按照“药品监管”,该类监管是指由企业通过注册IND并完成三期临床试验,最后作为药品上市销售;按照“医疗技术监管”,该类监管是指根据卫健委和药监局出台的《干细胞临床研究管理办法》,通过两委局的备案以后,开展研究者发起的干细胞临床研究。无论何种途径,其向临床转化的过程都必须遵守相关规定,严格执行行业标准。
随着细胞治疗产品的蓬勃发展和相应法规及技术指南的不断完善,干细胞临床研究和转化以按“药品管理”为主的趋势正逐渐明朗,研究者从早期的研究阶段开始,就必须考虑到作为药物研发亦或是临床研究备案时的方方面面,以提高转化效率。
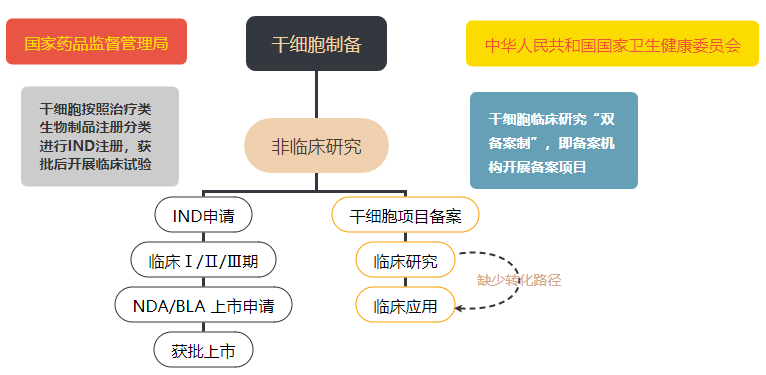
干细胞监管模式▲
点击看大图
相关法规指导要点
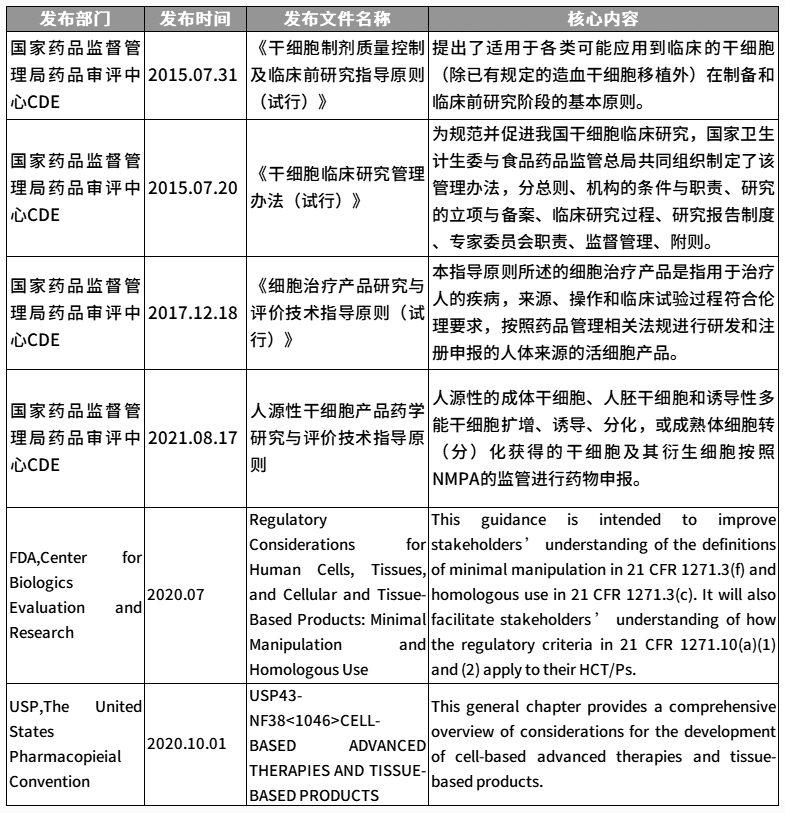
干细胞法规文件▲
点击看大图
回复“干细胞质量控制”,获取相关法规文件原件
根据相应法规和指导文件,对生产过程中的使用材料、生产工艺和过程控制、质量研究和控制、稳定性研究等的基本要求汇总如下:
01
相关依据
干细胞临床研究应当符合《药物临床试验质量管理规范》的要求;干细胞制剂符合《干细胞制剂质量控制及临床前研究指导原则(试行)》的要求;干细胞制剂的制备应当符合《药品生产质量管理规范》(GMP)的基本原则和相关要求。
02
全过程质量控制
所有干细胞制剂都可遵循一个共同的研发过程,即从干细胞制剂的制备、体外试验、体内动物试验,到植入人体的临床研究及临床治疗的过程。整个过程的每一阶段,都须对所使用的干细胞制剂在细胞质量、安全性和生物学效应方面进行相关的研究和质量控制。干细胞生产过程中的每一个生产步骤均应该进行研究与验证,并根据工艺特点设置重要工艺步骤的监控点,加强监控。
03
原材料控制
干细胞产品生产用的生物材料,如细胞株、培养基、滋养层细胞、动物来源的试剂和血清等,企业应当保证其来源合法、安全并符合质量标准,防止引入或传播传染病病原体。
04
产品检测
干细胞产品的检测机制建议采用质量检验和放行检验与专业检测机构复核检测相结合的方法,即这种“质量检验” -“放行检验” -“复核检验”的评价体系。
质量检验
为保证干细胞经特定体外处理后的安全性、有效性和质量可控性而进行的较全面质量检验。须对多批次干细胞制剂进行质量检验,检定项目应当建立在产品质量研究以及对生产工艺和生产过程充分理解的基础之上,同时兼顾产品的特性和当下的科学认知与共识。
放行检验
在完成质量检验的基础上,对每一类型的每一批次干细胞制剂,在临床应用前所应进行的相对快速和简化的细胞检验。可建立针对不同阶段关键制备工艺的过程控制,和针对不同组织来源批次及生产制备批次的中间细胞形态和终末制剂标准放行的评价规范。
质量复核
由专业细胞检验机构/实验室进行干细胞制剂的质量复核检验,并出具检验报告。
05
质量研究
干细胞产品的质量研究应选择有代表性的生产批次和合适的生产阶段样品(如初始分离的细胞、制备过程中细胞或成品等)进行研究。质量研究应涵盖细胞特性分析、功能性分析、纯度分析和安全性分析等方面,并且根据产品的自身特性可再增加其他相关的研究项目。
风险评估与控制
除了一般生物制品的常见风险外,干细胞产品的风险还包括污染和交叉污染的风险(供者、原材料、操作过程)、 高风险起始原材料(ESCs/iPSCs、基因递送与修饰系统)残留的风险、 加工过程中非目的细胞、非预期变化等杂质的风险、生产工艺变更的风险和干细胞产品的其他质量风险因素。
研发者应在综合考虑各种因素的基础上,针对不同类型产品特性和全生命周期过程评估产品的总体风险,并制定相应的风险控制策略。
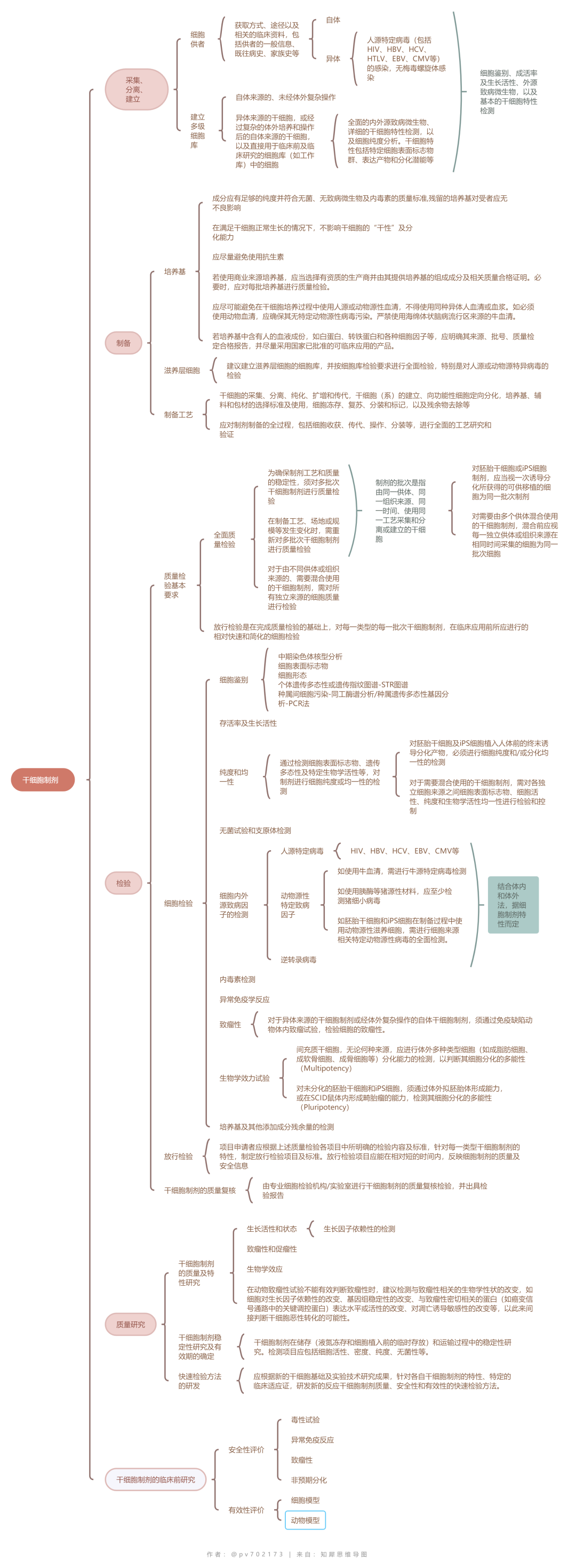
干细胞质量控制▲
点击看大图
武汉珈创生物相关服务
武汉珈创生物技术股份有限公司,创建于2011年,是一家集生物技术服务与研发为一体的高新技术企业,专注于为生物药品/制品的生产企业及研发机构提供各类细胞(含重组细胞、干细胞、免疫细胞等)及原辅料的质量检测、病毒清除工艺验证技术服务。
质量检测服务
武汉珈创生物可按相关法规或者指导文件提供干细胞治疗产品的各个生产环节的质量检测服务,包括:
基本生物学属性检测
细胞鉴别、细胞活性检测、种属间细胞污染的检测、染色体核型分析;
微生物学安全性检测
无菌检测、支原体检测,确保产品无微生物污染或代谢产物污染;
生物学安全性检测
成瘤性和致瘤性检测、异常免疫反应检测、残留物的检测;
生物学有效性评价
多向分化功能的评价、免疫调控功能的评价、hMSCs组织再生功能的评价
干细胞放行快检
珈创生物自主研发的放行快检技术,可在6小时内完成,涵盖细菌、真菌和支原体快检技术,且技术方法已成熟,经过了上百次验证。
定制化服务
针对特殊需求,我们还可提供定制化的检测服务,欢迎新老客户前来咨询。
参考资料:
[1]周萍,李昂,李欣,陆东哲,王晓熙,吴朝晖,薛迪.干细胞研究与临床应用的伦理规范与监管[J/OL].上海预防医学:1-5[2022-11-02].http://kns.cnki.net/kcms/detail/31.1635.R.20220721.1739.013.html
[2]王晶,黄云虹,高晨燕.我国间充质干细胞产品的注册申请情况及临床审评中的几点考虑[J].中国新药杂志,2022,31(15):1468-1473.
[3]一文览尽:中国干细胞药物注册申报和受理
https://mp.weixin.qq.com/s/PhoTzjxpVmGwahQe2K4nqw
[4]张可华,纳涛,韩晓燕,吴婷婷,张丽霞,贾春翠,袁翔鹤,冯建萍,项楠,孟淑芳.干细胞临床研究质量复核中发现的问题及初步分析[J].中国新药杂志,2021,30(19):1746-1751.

END