Jiachang Biological - biotechnology services and research and development as one of the high-tech enterprises
High qualityefficienttransparent
High quality, efficient and transparent
发布时间:2022-12-05 16:32 信息来源: 阅读次数: 次
来源于人或动物细胞系的生物技术产品的一个共同特点是存在病毒污染的风险,污染可来自原细胞系(细胞基质)本身,也可来自生产过程中偶然带入的外源病毒,这种污染可能产生严重的临床后果。
风险控制原则
控制生物技术产品的潜在病毒污染,可归纳为以下三条相互补充的原则:
a)选择并对选定的细胞系和其他原料进行检定,确保其不含可能对人有感染和/或致病作用的病毒。
b)评估生产工艺清除感染性病毒的能力。
c)检测生产适当步骤的产品,确保产品未受感染性病毒的污染。
各级细胞病毒安全性控制
细胞库包括原始细胞库(PCB,又称细胞种子)、主细胞库(MCB)和工作细胞库(WCB)。
ICH Q5A(R1)及USP-NF<1050>中对不同级别细胞进行病毒检测的建议:
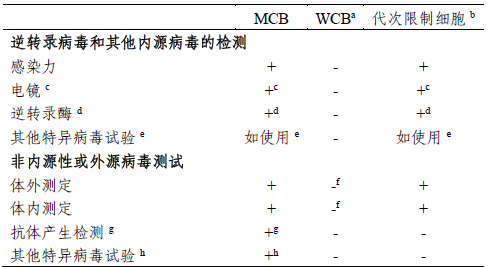
a.作为药物生产起始细胞基质的工作细胞库,必须进行外源病毒检测,既可对WCB进行直接测定,也可对从WCB来源的体外传代限度内的细胞进行分析。
b. 达到限传代次的细胞:在体外达到传代限度的生产细胞。
c. 也可测定其他因子。
d. 若逆转录病毒感染试验为阳性,则无须检测。
e. 指使用于已受此因子感染的细胞系。
f. 对第一个WCB,此测试应在该WCB产生的达到体外限传代次细胞上进行;以后的WCB,可直接在WCB上进行单项体外和体内测试,或在达到体外限传代次的细胞上测试。
g. 例如,MAP、RAP、HAP-通常适用于啮齿细胞系。
h. 例如,适用于人、非人灵长目或其他细胞的测试方法。
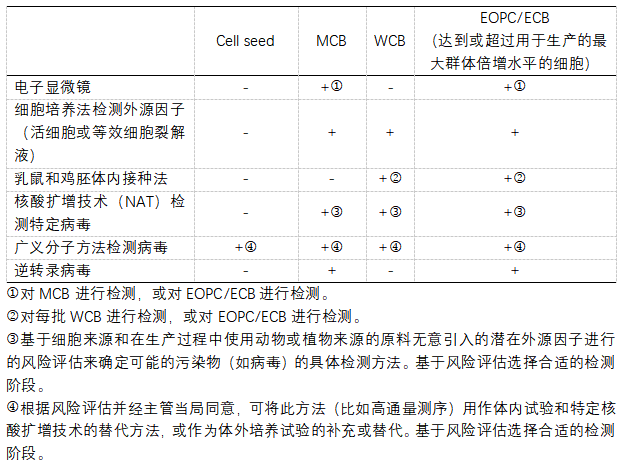
EP10.0 <5.2.3>中对不同级别细胞系进行病毒检测的建议:
中国药典三部(2020版)对细胞基质及细胞库体系的病毒检查的建议:
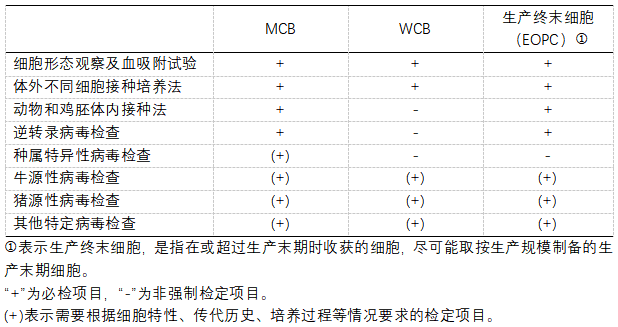
通过以上法规要求可以看出,对于细胞基质和各级细胞库,具体的检定项目需要根据特定的细胞特性、传代历史、培养过程、生产工艺等进行综合评估。根据ICH Q5A的要求,应对MCB进行内源性和非内源性病毒污染的检测;如果不检测MCB,也可以使用WCB全面检测进行替代。
生产过程中感染性病毒污染的风险控制
虽然在细胞库阶段对MCB 和WCB 进行了内外源病毒因子检测,但有些内源性病毒可能在MCB 和WCB 阶段未被检出,或者在生产过程中引入偶然的病毒因子污染,因而对生产终末细胞和/或细胞收获液中的病毒因子进行检测和控制非常重要。
对于UPB样品,ICH Q5A仅要求在进行上市注册申请时,至少应上报三批试生产或规模化生产的UPB研究资料,一般使用一种或几种细胞系进行体外筛查试验。如适用,可使用PCR试验或其他适当的方法。EMA文件《Guideline on Virus Safety Evaluation of Biotechnological Investigational Products》则指出,每一批用于临床试验的UPB均应按照ICH Q5A的要求进行检测,具体不同细胞系对应的检测方法也有不同。
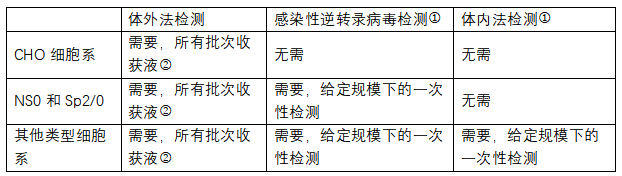
①如果可能,检测样品应包括细胞或细胞碎片以进行细胞相关病毒检测。对于灌注式细胞培养,生产商应确定并证明最适合的样品(含细胞的样品)收集步骤,收集超出批量生产代次的细胞检测样品也是可行的;在上述情况下,应证明采用分析方法的合理性;如果已有敏感度更高的方法可表明感染逆转录病毒检测结果为阴性,则感染性逆转录病毒的检测可忽略。②仅需在研发的特定阶段对前三批原液进行逆转录病毒或逆转录病毒颗粒的检测(如果制备批次不足三批,也可用更少批次)。
FDA指导文件《Points to Consider in the Manufacture and Testing of Monoclonal Antibody Products for Human Use》中则对UPB、纯化中间品和成品的病毒检测都有不同要求。对于每个批次收获液需要进行外源病毒因子、种属特异性病毒、逆转录病毒或逆转录病毒颗粒定量的检测。
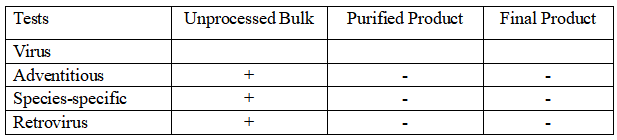
根据中国药典三部(2020版)要求对于人用生物制品生产用动物细胞基质及检定用动物细胞,需要对MCB进行全面检定,并且需要对EOPC进行检定。对于人用重组单克隆抗体制品生产,应根据生产过程及所用材料的特点,在合适的阶段进行常规或特定的外源病毒污染检查。除另有规定外,应对限定细胞传代次数的生产方式,采用适当的体外方法至少对3次收获物进行外源病毒检测。
相关法规指导
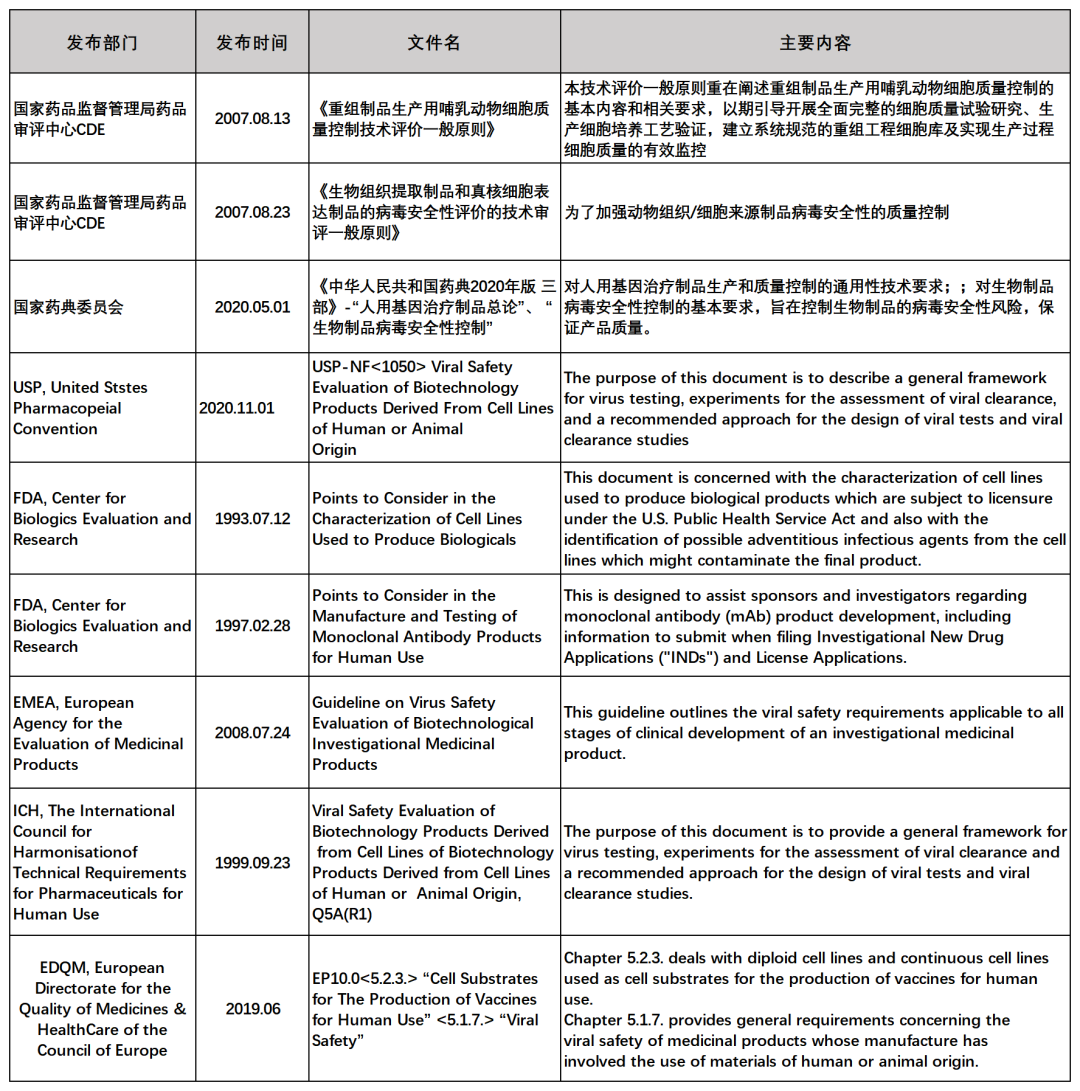
近年来,虽然对于内外源病毒因子检测中外申报要求各异,但2020年1月NMPA发布的“国家药监局关于适用《Q2(R1):分析方法论证:正文和方法学》等11个国际人用药品注册技术协调会指导原则的公告(2020年第7号)”中包含ICH Q5A(R1)和Q5B等文件,这表明国内法规正逐渐与国际相关法规接轨,给国内制药企业进行中外双报带来了便利,从而加速药品上市。
后台回复“病毒检测指导”,获取相关指导文件。
武汉珈创生物相关服务
武汉珈创生物技术股份有限公司,创建于2011年,是一家集生物技术服务与研发为一体的高新技术企业,专注于为生物药品/制品的生产企业及研发机构提供各类细胞(含重组细胞、干细胞、免疫细胞等)及原辅料的质量检测、病毒清除工艺验证技术服务。
质量检测服务
武汉珈创生物可按相关法规或指导原则提供各类细胞基质的成瘤性检查服务,且有多种检测方法可供选择如动物体内接种法(裸鼠)、软琼脂克隆形成试验、端粒酶活性检测等,至今已完成数万批次的细胞及产品检测服务。
定制化服务
针对特殊需求,我们还可提供定制化的检测服务,欢迎新老客户前来咨询。

END