Jiachang Biological - biotechnology services and research and development as one of the high-tech enterprises
High qualityefficienttransparent
High quality, efficient and transparent
发布时间:2020-08-11 13:13 信息来源: 阅读次数: 次
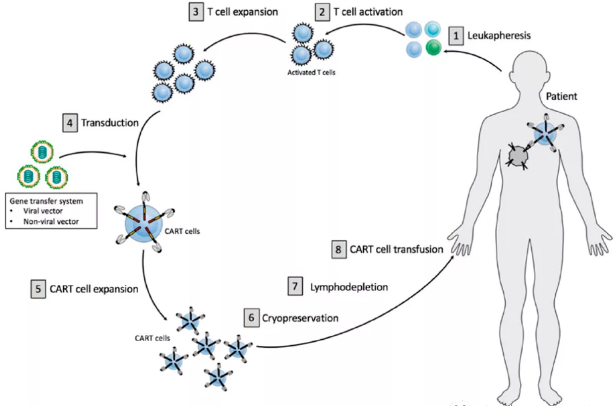

1. 细胞分离和富集
2. T细胞激活